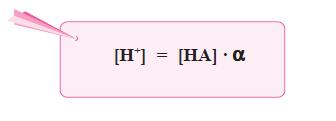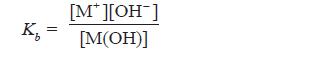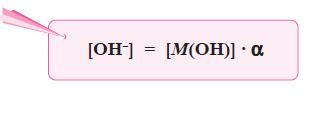A. Pengertian Asam Basa
Asam dan basa merupakan zat kimia yang banyak digunakan dalam kehidupan sehari hari.
1. Asam
Istilah asam (acid) berasal dari bahasa Latin “Acetum” yang berarti cuka, karena diketahui zat utama dalam cuka adalah asam asetat.secara umum asam yaitu zat yang berasa masam.
2. Basa
Basa (alkali) berasal dari ahasa arabyang berarti abu. Secara umum basa yaitu zat yang berasa pahit bersifat kaustik.
B. Teori Asam Basa
1. Teori Asam dan basa menurut Svante Arrhenius
Arrhenius menyatakan mulekul – mulekul zat elektrolit selalu menshasilkan ion – ion positif dan negatif jika dilarutkan dalam air. Pada tahun 1984 Ilmuan Swedia, Svante Arrhenius mengemukakan pengertian asam – asam berdasarkan reaksi ionisasi. Menurut Arrhenius, asam merupakan zat yang jika dilarutkan dalam air menghasilkan ion . Adapun basa merupakan zat yang jika dilarutkan dalam air akan menghasilkan ion .
Contoh senyawa Asam – Basa menurut Svante Arrhenius

2. Teori Asam dan Basa menurut Bronsted-Lowry
Pada tahun 1923, ilmwuan Denmark Johannes Bronsted dan Ilmuwan Inggris Thomas Lowry mengemukakan teori asam dan basah berdasarkan serah terima proton.
Teori
- Asam adalah donor proton (ion hidrogen).
- Basa adalah akseptor proton (ion hidrogen).
Pengertian asam dan basa yang dikemukakan oleh Bronsted – Lowry memperbaiki kelemahan teori asam – basa Arrhenius. Pengertian asam – basa Arrhenius hanya berlaku untuk senyawa yang larut dalam pelarut air karena reaksi ionisasi yang menghasilkan ion dan ion hanya terjadi dalam pelarut air.
Dalam suatu persamaan reaksi asam – basa berdasarkan teori Bronsted – Lowry, suatu asam dan basa masing – masing mempunyai pasangan. Pasangan asam disebut basa konjugasi sedangkan pasangan basa disebut asam konjugasi.
3.Teori Asam Basa menurut Lewis
Menurut pandangan ini, bahwa asam adalah struktur yang mempunyai afinitas terhadap paangan elektron yang diberikan oleh basa. Dimana basa tersebut didefenisikan sebagai zat yang mempunyai pasangan elektron yang belum mendapat pemilikan bersama. (Rosenberg,1985)
Lewis juga mengkelompokan senyawa sebagai asam dan basa menurut kemampuannya melepaskan / menerima electron. Menurut lewis :
Asam : Senyawa yang menerima pasangan electron
Senyawa dengan electron valensi <8
Basa : Senyawa yang mendonorkan pasangan electron
Mempunyai pasangan electron bebas
Contoh: reaksi antara NH3 dan BF3
H3N: + BF3 H3N BF3
Nitrogen mendonorkan pasangan elektron bebas kepada boron. Pasangan bebas yang didonorkan ditandaai dengan tanda panah antara atom nitrogen dan boron.
C. Identifikasi Asam – Basa
Senyawa asam dapat dibedakan dari senyawa basa, salah satunya dengan mencicipi rasanya. Namun, tidak semua zat dapat di identifikasi dengan cara itu. Senyawa – senyawa asam-basa dapat diidentifikasi secara aman dengan menggunakan indikator. Indikator merupakan zat warna yang warnanya berbeda jika berada dalam kondisi asam dan basa. Indikator yang dapat digunakan adalah kertas lakmus, indikator asam – basa dan indikator alami.
1. Mengidentifikasi asam – basa dengan kertas lakmus
 Senyawa sam – basa dapat diidentifikasi menggunakan kertas lakmus dengan cara mengamati perubahan warna kertas lakmus ketika bereaksi dengan larutan. Ada dua macam kertas lakmus yaitu kertas lakmus merah dan kertas lakmus biru.
Senyawa sam – basa dapat diidentifikasi menggunakan kertas lakmus dengan cara mengamati perubahan warna kertas lakmus ketika bereaksi dengan larutan. Ada dua macam kertas lakmus yaitu kertas lakmus merah dan kertas lakmus biru.
Ketika dicelupkan dalam larutan asam dan larutan basa, kertas lakmus merah dan lakmus biru akan menghasilkan perubahan warna yang berbeda. Larutan yang bersifat asam adalah air jeruk dan larutan cuka, sedangkan larutan yang bersifat basa adalah air sabun dan larutan soda kue.
Kertas lakmus merah yang dicelupkan dalam larutan asam tidak akan berubah warna, jika kertas tersebut dicelupkan pada larutan basa akan berubah warna menjadi biru. Sebaliknya, jika kertas lakmus biru yang dicelupkan kelarutan asam, lakmus akan berubah menjadi merah. Adapaun jika dicelupkan kelarutan basa, warnanya tetap biru.
2. Mengidentifikasi asam – basa dengan indikator asam – basa
Selain kertas lakmus, kita juga dapat menggunakan indikator asam – basa untuk membedakan asam dan basa. Indikator asm – basa adalah zat kimia yang mempunyai warna yang berbeda dalam larutan asam dan basa. Sifat itulah yang menyebabkan indikator asam – basa dapat digunakan untuk mengidentifikasi sifat asam dan basa. Ada beberapa jenis indikator asam – basa diantaranya fenolftalein, metil orange, bromotimul biru, metil ungu, bromokresol ungu, fenol merah, timolftalein dan metil orange.

Jika kita meneteskan larutan asam – basa kedalam larutan tersebut, kita akan melihat perubahan warna larutan indikator. Perhatikan tabel berikut:
3.Mengidentifikasi Asam–Basa dengan indikator alami
Selain indikator buatan, kamu juga dapat mengidentifikasi senyawa asam dan basa menggunakan indikator alami. Indikator tersebut dapat dibuat dari bumbu dapur, bunga dan buah – buahan.
D. Kekuatan Asam Basa
1. Kekuatan Asam
Kekuatan asam dipengaruhi oleh banyaknya ion – ion H+ yang dihasilkan oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+ yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
1). Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) ⎯⎯→ H+(aq) + A–(aq)

2). Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan ukuran kekuatan asam, makin besar Ka makin kuat asam.
Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–], maka persamaan di atas dapat diubah menjadi:
- Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya.
- Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
2. Kekuatan Basa
1). Basa Kuat
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan.
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)
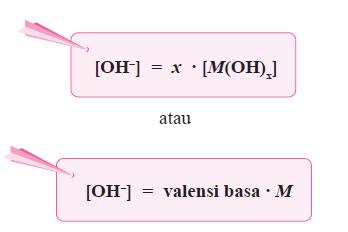
dengan: x = valensi basa
M = konsentrasi basa
2.). Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:
1.Konsep pH
- Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada tahun 1910, seorang ahli dari Denmark, Soren Lautiz Sorensen memperkenalkan suatu bilangan yang sederhana.
- Bilangan ini diperoleh dari hasil logaritma konsentrasi H+.
- Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1 – 14 dan ditulis:
- Dari uraian di atas dapat kita simpulkan bahwa:
a. Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH < 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH > 7.
- Karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif, maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda sebesar n mempunyai perbedaan ion H+ sebesar 10n.
- Perhatikan contoh di bawah ini.
- Jika konsentrasi ion H+ = 0,01 M, maka pH = – log 0,01 = 2
- Jika konsentrasi ion H+ = 0,001 M (10 kali lebih kecil) maka pH = – log 0,001 = 3 (naik 1 satuan)
- Jadi dapat disimpulkan:
• Makin besar konsentrasi ion H+ makin kecil pH
• Larutan dengan pH = 1 adalah 10 kali lebih asam daripada larutan dengan pH = 2.
2. Pengukuran pH
- Untuk menentukan pH suatu larutan dapat dilakukan dengan beberapa cara, antara lain sebagai berikut.
1). Menggunakan Beberapa Indikator
- Indikator adalah asam organik lemah atau basa organik lemah yang dapat berubah warna pada rentang harga pH tertentu (James E. Brady, 1990).
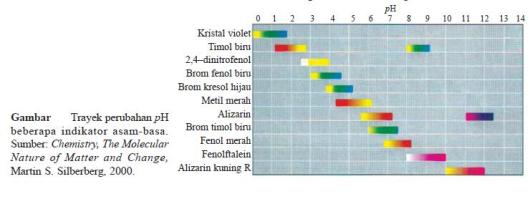
- Harga pH suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator.
- Indikator memiliki trayek perubahan warna yang berbeda-beda.
- Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
- Contoh, suatu larutan dengan brom timol biru (6,0– 7,6) berwarna biru dan dengan fenolftalein (8,3–10,0) tidak berwarna, maka pH larutan itu adalah 7,6–8,3.
- Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak berwarna, berarti pH larutan kurang dari 8,3.
2). Menggunakan Indikator Universal

3). Menggunakn pH Meter
pH Meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi