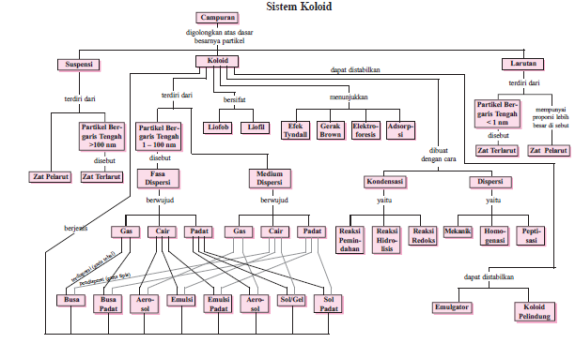
Peta Konsep Sistem Koloid
A. Pengertian Koloid
 Istilah koloid pertama kali diutarakan oleh seorang ilmuwan Inggris, Thomas Graham, sewaktu mempelajari sifat difusi beberapa larutan melalui membrane kertas perkamen. Graham menemukan bahwa larutan natrium klorida mudah berdifusi sedangkan kanji, geatin dan putih telur sangat lambat atau sama sekali tidak berdifusi. Zat-zat yang sukar berdifusi disebut koloid (Handayana, 2002).
Istilah koloid pertama kali diutarakan oleh seorang ilmuwan Inggris, Thomas Graham, sewaktu mempelajari sifat difusi beberapa larutan melalui membrane kertas perkamen. Graham menemukan bahwa larutan natrium klorida mudah berdifusi sedangkan kanji, geatin dan putih telur sangat lambat atau sama sekali tidak berdifusi. Zat-zat yang sukar berdifusi disebut koloid (Handayana, 2002).
Tahun 1907, Ostwald menemukan istilah system terdipersi bagi zat yang terdispersi dalam medium pendispersi. analogi daam larutan fase terdispersi adalah zat terlarut sedangkan meium pendispersi adalah zat pelarut. Sistem koloid termasuk salah satu sistem dispersi. Sistem dispersi lainnya adalah larutan dan suspensi. Larutan merupakan sistem dispersi yang ukuran partikelnya sangat kecil, sehingga tidak dapat dibedakan antara partikel disperse dan pendispersinya. Sedangkan suspensi merupakan system disperse dengan partikel berukuran besar yang tersebar merata dalam medium pendispersinya. sistem koloid suatu bentuk campuran yang keadaannya terletak antara larutan dan suspensi (campuran kasar). Secara makroskopis koloid tampak homogen, tetapi secara mikroskopis bersifat heterogen. Campuran koloid umumnya bersifat stabil dan tidak dapat disaring. ukuran partikel koloid terletak antara 1nm-100 nm (Handayana, 2002).
B. Perbedaan antara larutan, koloid dan suspensi

- Larutana adalah campuran homogen dari dua atau lebih zat. Hal ini disebut campuran homogen, karena komposisi adalah seragam di seluruh larutannya. Komponen larutan terutama dari dua jenis, zat terlarut dan pelarut. Pelarut melarutkan zat terlarut dan membentuk larutan yang seragam. Contoh: larutan NaCl, minuman ringan berkarbonat yang mengandung CO2 yang kuat (James E Brady. 1999. 572-573)
- Suspensi adalah suatu campuran dimana paling sedikit satu komponen yang secara relatif mempunyai partikel besar yang akan saling tersebar dengan komponen lainnya. Contoh: pasir yang halus yang tersuspensi dalam air, salju yang ditiup ke udara, endapan yang terbentuk pada campuran reaksi.
- Koloid merupakan campuran dari dua zat atau lebih dimana partikel terdispersinya berukuran 1 nm sampai 1000 nm. (John W.Hill and Ralph H Petrucci. 2005: 365) Contoh: semprotan aerosol (cairan tersuspensi dalam gas), susu (tetesan kecil minyak dan padatan dalam air), mayones (tetesan kecil air dalam minyak)(Oxtoby Gillis Machtrieb.1998.78)Secara garis besar, perbandingan antara larutan, dan suspensi dapat dilihat pada tabel dibawah ini.

C. Pengelompokan Sistem Koloid
Dalam sistem koloid terdapat tiga fase zat, yaitu padat, cair, dan gas. Dari ketiga fase ini terbagi kedalam delapan sistem koloid. Adapun kedelapan sistem koloid tersebut adalah:
- Sistem Koloid Fase Padat-Cair (Sol)Dengan fase terdispersi berupa zat padat dan medium pendispersi berupa zat cair. Contoh sol/gel yaitu agar-agar, pektin(selai), gelatin(jelly), cairan kanji, air sungai, tinta, cat, gel kalsium asetat dalam alkohol, sol emas, sol Fe(OH)3, sol Al(OH)3, dan sol belerang.
- Sistem Koloid Fase Padat-Padat (Sol Padat)Dengan fase terdispersi berupa zat padat dan medium pendispersi berupa zat padat. Contoh sol padat yaitu kaca berwarna dan logam campuran (aloi) seperti stainless steel (campuran antara besi, nikel, dan kromium).
- Sistem Koloid Fase Padat-Gas (Aerosol Padat)Dengan fase terdispersi berupa zat padat dan medium pendispersi berupa zat gas. Contoh aerosol padat yaitu asap
- Sistem Koloid Fase Cair-Gas (Aerosol)Dengan fase terdispersi berupa zat cair dan medium pendispersi berupa zat gas. Contoh aerosol yaitu kabut, awan, parfum, hairspray, cat semprot dan lain-lain.
- Sistem Koloid Fase Cair-Gas (Aerosol)Dengan fase terdispersi berupa zat cair dan medium pendispersi berupa zat gas. Contoh aerosol yaitu kabut, awan, parfum, hairspray, cat semprot dan lain-lain.
- em Koloid Fase Cair-Padat (Emulsi Padat)Dengan fase terdispersi berupa zat cair dan medium pendispersi berupa zat padat. Contoh emulsi padat yaitu keju, mentega, dan mutiara.
- Sistem Koloid Fase Gas-Cair (Busa)Dengan fase terdispersi berupa zat gas dan medium pendispersi berupa zat cair. Contoh busa yaitu buih.
- Sistem Koloid Fase Gas-Padat (Busa Padat)Dengan fase terdispersi berupa zat gas dan medium pendispersi berupa zat padat. Contoh busa padat yaitu karet busa dan batu apung.
D. Sifat – Sifat dan Penerapan Sistem Koloid :
- Efek Tyndall.
 Partikel debu, banyak diantaranya terlalu kecil untuk dilihat, akan nampak sebagai titik-titik terang dalam suatu berkas cahaya. Bila partikel itu memang berukuran koloid, partikel itu sendiri tidak nampak; yang terlihat ialah cahaya yang dihamburkan oleh mereka. Hamburan cahaya itu disebut efek tyndall. Ini disebabkan oleh fakta bahwa partikel kecil menghamburkan cahaya dalam segala arah.
Partikel debu, banyak diantaranya terlalu kecil untuk dilihat, akan nampak sebagai titik-titik terang dalam suatu berkas cahaya. Bila partikel itu memang berukuran koloid, partikel itu sendiri tidak nampak; yang terlihat ialah cahaya yang dihamburkan oleh mereka. Hamburan cahaya itu disebut efek tyndall. Ini disebabkan oleh fakta bahwa partikel kecil menghamburkan cahaya dalam segala arah.
Efek tyndall dapat digunakan untuk membedakan dispersi koloid dan suatu larutan biasa, karena atom, molekul, ataupun muaatan yang berbeda dalam suatu larutan tidak menghamburkan cahaya secara jelas dalam contoh-contoh yang tebalnya tak seberapa. Penghamburan cahaya tyndall dapat menjelaskan betapa buramnya dispersi koloid. Misalnya, meskipun baik minyak zaitun maupun air itu tembus cahaya, dispersi koloid dari kedua zat ini nampak seperti susu.
2. Gerak Brown
 Jika suatu mikroskop optis difokuska pada suatu dispersi koloid pada arah yang tegak lurus pada berkas cahaya dan dengan latar belakang gelap, akan nampak partikel-partikel koloid, bukan sebagai partikel dengan batas yang jelas, melainkan sebagai bintik yang berkilauan. Dengan mengikuti bintik-bintik cahaya yang dipantulkan ini, orang dapat melihat bahwa partikel koloid yang terdispersi ini bergerak terus-menerus secara acak menurut jalan yang berliku-liku. Gerakan acak partikel koloid dalam suatu medium pendispersi ini disebut gerakan brown, menurut nama seorang ahli botani Inggris, Robert Brown, yang mempelajarinya dalam tahun 1827.
Jika suatu mikroskop optis difokuska pada suatu dispersi koloid pada arah yang tegak lurus pada berkas cahaya dan dengan latar belakang gelap, akan nampak partikel-partikel koloid, bukan sebagai partikel dengan batas yang jelas, melainkan sebagai bintik yang berkilauan. Dengan mengikuti bintik-bintik cahaya yang dipantulkan ini, orang dapat melihat bahwa partikel koloid yang terdispersi ini bergerak terus-menerus secara acak menurut jalan yang berliku-liku. Gerakan acak partikel koloid dalam suatu medium pendispersi ini disebut gerakan brown, menurut nama seorang ahli botani Inggris, Robert Brown, yang mempelajarinya dalam tahun 1827.
3. Adsorpsi
Materi dalam keadaan koloid mempunyai luas permukaan yang sangat besar. Pada permukaan partikel terdapat gaya van der waals yang belum terimbangi atau bahkan gaya valensi yang dapat menarik dan mengikat atom-atom (molekul-molekul) dari zat asing. Adhesi zat-zat asing ini pada permukaan suatu partikel disebut adsorpsi. Zat-zat teradsorpsi terikat dengan kuat dalam lapisan-lapisan yang biasanya tebalnya tidak lebih dari satu atau dua molekul. Banyaknya zat asing yang dapat diadsorpsi bergantung pada luasnya permukaan yang tersingkap. Meskipun adsopsi merupakan suatu gejala umum dari zat padat, adsorpsi ini teristimewa efisiensinya dengan materi koloid yang disebabkan oleh besarnya luas permukaan itu.
4. Koagulasi
Telah disebutkan bahwa koloid distabilkan oleh muatannya. apabila muatan koloid dilucuti maka kestabilan akan berkurang dan dapat menyebabkan koagulasi atau penggumpalan. Pelucutan muatan koloid dapat terjadi pada sel elektroforesis atau jika elektrolit ditambahkan kedalam sistem koloid. Apabila arus listrik dialirkan cukup lama kedalam sel elektroforesis maka partikel koloid akan digumpalkan ketika mencapai elektrode. Jadi, koloid yang bermuatan negatif akan digumpalkan di anode, sedangkan koloid yang bermuatan positif digumpalkan di katode.
5. Koloid Pelindung
Pada beberapa proses, suatu koloid harus dipecahkan. Misalnya, koagulasi lateks. Dilain pihak, koloid perlu dijaga supaya tidak rusak. Suatu koloid dapat distabilkan dengan mmenambahkan koloid lain yang disebut koloid pelindung. Koloid pelindung akan membungkus partikel zat terdispersi sehingga tidak dapat lagi mengelompok.
6. Dialisis
Pemisahan muatan dari koloid dengan difusi lewat pori-pori suatu selaput semipermeabel disebut dialisis. Pori-pori itu biasanya berdiameterkurang dari 10 Å dan membiarkan lewatnya molekul air dan muatan-muatan kecil. Selaput hewani alamiah, kertas perkamen, selofan dan beberapa plastic sintetik merupakan bahan selaput yang sesuai. Partikel-partikel yang melewati membran agaknya berlaku demikian tidak sekedar berdasarkan difusi acak. Mereka teradsorpsi pada permukaan membran dan bergerak dari letak ( site ) adsorben yang satu ke yang lain pada waktu mereka bergerak melewati pori-pori itu. ( Oxtoby, 2001)
E. Cara Pembuatan Koloid
Larutan koloid dapat dibuat dengan dua cara yaitu
1.Kondensasi
Kondensasi adalah penggabungan partikel – partikel halus ( molekuler ) menjadi partikel yang lebih besar. Pembuatan koloid dengan cara ini dilakukan melalui :
a. Cara Kimia
Partikel koloid dibentuk melalui reaksi – reaksi kimia, seperti reaksi hidrolisis, reaksi reduksi oksidasi, atau reaksi subtitusi.
- Hidrolisis : Merupakan reaksi suatu zat dengan air
- Reaksi Redoks : Merupakan reaksi yang disertai perubahan biloks
- Reaksi Subtitusi : Merupakan reaksi penggantian
b. Cara Fisika
Dilakukan dengan jalan menurutkan kelarutan dari zat terlarut, yaitu dengan jalan pendinginan atau mengubah pelarut sehingga terbentuk satu sol koloid.
2.Dispersi
Pembuatan koloid dengan cara dispersi merupakan pemecahan partikel – partikel kasar menjadi partikel yang lebih halus/lebih kecil dapat dilakukan secara mekanik, peptisasi atau dengan loncatan bunga listrik ( listrik busur breding ).
a. Cara Mekanik
Dengan cara ini butir – butir kasar digerus dengan lumpang atau penggiling koloid sampai diperoleh tingkat kehalusan tertentu kemudian diaduk dengan medium dispersi.Contoh : Sol belerang dibuat dengan menggerus serbuk belerang bersama – sama dengan suatu zat inert (seperti gula pasir ) kemudian mencampur serbuk halus dengan air
b. Peptisasi
Pembuatan koloid dengan cara peptisasi adalah membuat koloid dari butir – butir kasar atau dari suatu endapan dengan bantuan suatu zat pemeptisasi ( pemecahan ). Contoh : Agar – agar dipeptisasi oleh air, nitroselulosa oleh aseton, karet oleh bensin dan lain – lain. (Oxtoby, 2001)