BAB I
PENDAHULUAN
A. Latar Belakang
Pendidikan merupakan usaha manusia untuk mengubah dan membina kepribadian berlandaskan dengan nilai-nilai baik didalam masyarakat maupun kebudayaan melalui proses pendidikan. Dalam hal ini, pendidikan sangat erat kaitannya dengan pembelajaran. Dimana belajar pada dasarnya merupakan kunci yang paling vital dalam setiap usaha pendidikan. Sebaliknya dengan adanya belajar bisa membuat seseorang yang sebelumnya tidak tahu dan tidak mengerti menjadi tahu dan mengerti (Ngalim Purwanto, 1990: 84).
Belajar merupakan kegiatan manusia untuk merubah dirinya dari ketidak tahuan menjadi tahu, dari ke samaran menjadi jelas, dan tentunya dalam proses pelaksanaan belajar tidak akan terlepas dari pengaruh-pengaruh yang datang sebagai stimulus yang dapat merangsang cepat atau lambatnya bahkan berhasil atau tidaknya sebuah proses belajar.
Sains atau Ilmu Pengetahuan Alam adalah ilmu yang pokok bahasannya adalah alam dengan segala isinya. Hal yang dipelajari dalam sains adalah sebab-akibat, hubungan kausal dari kejadian-kejadian yang terjadi di alam. Hal ini berarti, belajar sains tidak hanya belajar dalam wujud pengetahuan deklaratif berupa fakta, konsep, prinsip, hukum, tetapi juga belajar tentang pengetahuan prosedural berupa cara memperoleh informasi, cara sains dan teknologi bekerja, kebiasaan bekerja ilmiah, dan keterampilan berpikir.
Belajar sains memfokuskan kegiatan pada penemuan dan pengolahan informasi melalui kegiatan mengamati, mengukur, mengajukan pertanyaan, mengklasifikasi, memecahkan masalah, dan sebagainya. Pembelajaran sains menekankan pada pemberian pengalaman langsung. Dengan demikian, siswa perlu dibantu untuk mampu mengembangkan sejumlah pengetahuan yang menyangkut kerja ilmiah dan pemahaman konsep serta aplikasinya
B. Rumusan Masalah
- Bagaimana cara mengajarkan Sains?
- Faktor-faktor yang mempengaruhi proses pembelajaran?
C. Tujuan Pembelajaran
- Mampu mengetahui bagaimana cara mengajarkan sains.
- Mampu mengetahui faktor-faktor yang mempengaruhi proses pembelajaran.
BAB II
ISI
A. Cara Mengajarkan Sains
Sains atau Ilmu Pengetahuan Alam adalah ilmu yang pokok bahasannya adalah alam dengan segala isinya. Hal yang dipelajari dalam sains adalah sebab-akibat, hubungan kausal dari kejadian-kejadian yang terjadi di alam. Carin dan Sund (1993) mendefinisikan sains sebagai pengetahuan yang sistematis atau tersusun secara teratur, berlaku umum, dan berupa kumpulan data hasil observasi dan eksperimen. Aktivitas dalam sains selalu berhubungan dengan percobaan-percobaan yang membutuhkan keterampilan dan kerajinan. Secara sederhana, sains dapat juga didefinisikan sebagai apa yang dilakukan oleh para ahli sains. Dengan demikian, sains bukan hanya kumpulan pengetahuan tentang benda atau makhluk hidup, tetapi menyangkut cara kerja, cara berpikir, dan cara memecahkan masalah. Ilmuwan sains selalu tertarik dan memperhatikan peristiwa alam, selalu ingin mengetahui apa, bagaimana, dan mengapa tentang suatu gejala alam dan hubungan kausalnya.
Dalam sains, terdapat tiga unsur utama, yaitu sikap manusia, proses atau metodologi, dan hasil yang satu sama lain tidak dapat dipisahkan. Sikap manusia yang selalu ingin tahu tentang benda-benda, makhluk hidup, dan hubungan sebab-akibatnya akan menimbulkan permasalahan-permasalahan yang selalu ingin dipecahkan dengan prosedur yang benar. Prosedur tersebut meliputi metode ilmiah. Metode ilmiah mencakup perumusan hipotesis, perancangan percobaan, evaluasi atau pengukuran, dan akhirnya menghasilkan produk berupa fakta-fakta, prinsip-prinsip, teori, hukum, dan sebagainyA
1. Sains dan Proses Pembelajaran
Sains pada dasarnya mencari hubungan kausal antara gejala-gejala alam yang diamati. Oleh karena itu, proses pembelajaran sains seharusnya mengembangkan kemampuan bernalar dan berpikir sistematis selain kemampuan deklaratif yang selama ini dikembangkan. Salah satu inovasi sebagai salah satu usaha adalah mencari model-model pembelajaran sains yang memiliki kontribusi terhadap peningkatan mutu pendidikan sains.
Hal ini berarti, belajar sains tidak hanya belajar dalam wujud pengetahuan deklaratif berupa fakta, konsep, prinsip, hukum, tetapi juga belajar tentang pengetahuan prosedural berupa cara memperoleh informasi, cara sains dan teknologi bekerja, kebiasaan bekerja ilmiah, dan keterampilan berpikir. Belajar sains memfokuskan kegiatan pada penemuan dan pengolahan informasi melalui kegiatan mengamati, mengukur, mengajukan pertanyaan, mengklasifikasi, memecahkan masalah, dan sebagainya.
Pembelajaran sains menekankan pada pemberian pengalaman langsung. Dengan demikian, siswa perlu dibantu untuk mampu mengembangkan sejumlah pengetahuan yang menyangkut kerja ilmiah dan pemahaman konsep serta aplikasinya. Bahan kajian kerja ilmiah adalah :
- mampu menggali pengetahuan melalui penyelidikan/ penelitian,
- mampu mengkomunikasikan pengetahuannya,
- mampu mengembangkan keterampilan berpikir,
- mampu mengembangkan sikap dan nilai ilmiah.
Selanjutnya, bahan kajian sains yang berkaitan dengan pemahaman konsep dan penerapannya adalah:
- memiliki pengetahuan, pemahaman, dan aplikasinya tentang makhluk hidup dan proses kehidupan.
- memiliki pengetahuan, pemahaman, dan aplikasinya tentang materi dan sifatnya.
- memiliki pengetahuan, pemahaman, dan aplikasinya tentang energi dan perubahannya.
- memiliki pengetahuan, pemahaman, dan aplikasinya tentang bumi dan alam semesta.
- memiliki pengetahuan, pemahaman, dan aplikasinya tentang hubungan antara sains, lingkungan, teknologi, dan masyarakat.
Keterampilan proses yang dapat dikembangkan dalam pembelajaran sains, diantaranya adalah keterampilan mengamati dengan seluruh indera, mengajukan hipotesis, menggunakan alat dan bahan secara benar dengan selalu mempertimbangkan keselamatan kerja, mengajukan pertanyaan, menggolongkan, menafsirkan, mengkomunikasikan, hasil temuan secara beragam, menggali dan memilah informasi faktual untuk menguji gagasan atau memecahkan masalah sehari-hari.
Pembelajaran sains, yaitu cara memberi tahu dan cara berbuat, akan membantu siswa untuk memperoleh pemahaman yang mendalam tentang alam sekitarnya dengan mendudukkan siswa sebagai pusat perhatian dalam interaksi aktif dengan teman, lingkungan, dan nara sumber lainnya.
2. Pendekatan dalam pembelajaran sains
a. Pendekatan induktif
Merupakan pendekatan pembelajaran yang dimulai dari yang khusus sampai atau menuju yang umum, atau mulai dari contoh-contoh sampai suatu kesimpulan
b. Pendekatan deduktif
Merupakan kebalikan dari pendekatan induktif, yaitu pendekatan yang dimulai dari yang umum sampai atau menuju pada yang khusus, atau dimulai dari kesimpulan sampai kepada contoh-contoh
c. Pendekatan Lingkungan
Merupakan pendekatan yang mengarahkan anak didik memanfaatkan lingkungan sebagai sumber belajar. Dalam pelaksanaan pendekatan lingkunagn umumnya anak didik di bawa belajar keluar kelas. Tapi tidaklah mustahil dalam kondisi tertentu atau untuk mempelajari objek tertentu dapat dilaksanakan membawa lingkungan ke dalam kelas atau kedalamlaboratorium.
d.Pendekatan konsep
Merupakan pendekatan yang mengarahkan anak didik untuk menguasai konsep secara benar. Pendekatan ini sangat penting untuk menghindari anak didik salah konsep.
e. Pendekatan proses
Merupakan Pendekatan proses merupakan pendekatan pembelajaran yang menekankan pada proses belajar, aktivitas dan kreatifitas peserta didik dalam memperoleh pengetahuan, keterampilan, nilai dan sikap, serta menerapkannya dalam kehidupan sehari-hari. Bila anak didik sudah dapat melakukan proses pembelajaran dengan baik dan benar di asumsikan akan dapat menerima hasil belajar dengan baik.
f. Pendekatan pemecahan masalah (problem solving)
Merupakan pendekatan yang mengarahkan atau melatih anak didik untuk mampu memecahkan masalah dalam bidang ilmu atau bidang studi yang dipelajari. Masalah adalah perbedaan ataukesenjangan yang terjadi antara yang diinginkan dengan kenyataan yang terjadi sehingga timbul keinginan untuk memecahkannya atau mencari solusi.
g. Pendekatan inkuiri
Merupakan pendekatan yang mengarahkan anak didik untuk menemukan pengetahuan, ide dan informasi melalui usaha sendiri.
h. Pendekatan sains teknologi masyarakat
Pada dasarnya pendekatan sains teknologi masyarakat dalam pembelajaran dilaksanakan oleh guru melalui topik yang dibahas dengan jalan menghubungkan antara sains dan teknologi yang terkait dengan kegunaanya di masyarakat. Tujuannya antara lain adaah untuk meningkatkan motivasi dan prestasi belajar di samping memperluas wawasan peserta didik.
3 . Beberapa Metode dalam Pembelajaran Sains
a. Metode ceramah
b. Metode tanya jawab
c. Metode demonstrasi
d. Metode diskusi
e. Metode eksperimen
f. Metode latihan
h. Metode karya wisata
4. Prinsip- Prinsip Pembelajaran Sains
a. Keterlibatan secara aktif
b. Belajar berkesinambungan.
c. Motivasi
d. Multi Saluran
e. Penemuan
f. Totalitas
g. Perbedaan Individual
B. Faktor-Faktor yang Mempengaruhi Proses Belajar
1. Pengertian Belajar
Belajar adalah kunci yang paling vital dalam setiap usaha pendidikan, sehingga tanpa belajar sesungguhnya tak pernah ada pendidikan. Sebagai suatu proses, belajar hampir selalu mendapat tempat yang luas dalam berbagai disiplin ilmu yang berkaitan dengan upaya kependidikan, misalnya psikologi pendidikan dan psikologi belajar. Karena demikian pentingnya arti belajar, maka bagian terbesar upaya riset dan eksperimen psikologi belajarpun diarahkan pada tercapainya pemahaman yang lebih luas dan mendalam mengenai proses perubahan manusia itu.
Pengertian belajar menurut James Owhittaker adalah “Learning is the process by wich behavior (in the broader sense originated of changer through practice or training)”, artinya belajar adalah proses dimana tingkah laku (dalam arti luas ditimbulkan atau diubah melalui praktek atau latihan) (Mardianto, 2009: 34).
Belajar adalah serangkai kegiatan jiwa raga untuk memperoleh suatu perubahan tingkah laku sebagai hasil pengalaman individu dalam interaksi dengan lingkungannya yang menyangkut kognitif, afektif dan psikomotorik (Syaiful Bahri Djamarah, 2002: 13).
Belajar dilakukan dengan sengaja atau tidak sengaja dengan guru atau tanpa guru, dengan bantuan orang lain, atau tanpa dibantu dengan siapapun. Belajar juga diartikan sebagai usaha untuk membentuk hubungan antara perangsang atau reaksi. Menurut para pakar psikologi belajar bahwa pengalaman hidup sehari-hari dalam bentuk apa pun sangat memungkinkan untuk diartikan sebagai belajar. Alasannya, sampai batas tertentu pengalaman hidup juga berpengaruh besar terhadap pembentukan kepribadian organisme yang bersangkutan (Muhibbin Syah, 2003: 65).
Ciri-ciri belajar adalah sebagai berikut:
Belajar harus memungkinkan terjadinya perubahan perilaku pada diri individu. Perubahan tersebut tidak hanya pada aspek pengethauan atau kognitif saja tetapi juga meliputi aspek sikap dan nilai (afektif) serta keterampilan (psikomotor).
- Perubahan itu merupakan buah dari pengalaman. Perubahan perilaku yang terjadi pada individu karena adanya interaksi antara dirinya dengan lingkungan. interaksi ini dapat berupa interaksi fisik dan psikis.
- Perubahan perilaku akibat belajar akan bersifat cukup permanen.
2. Pendekatan dan Objek dalam Psikologi Belajar
Proses belajar dapat diketahui dengan dua pendekatan, yaitu :
- Mempelajari belajar langsung di lapangan yang sebenarnya atau biasa disebut dengan naturalistic observation, yaitu cara pendekatan yang langsung pada peristiwa yang terjadi secara alami.
- Pendekatan melalui laboratorium yaitu mempelajari masalah belajar di laboratorium. Keadaan laboratorium pada umumnya akan mereduksi keadaan sebenarnya.
Adapun yang menjadi objek atau sasaran psikologi belajar ini adalah tertuju pada dua bagian yang berbeda sebagaimana psikologi lainnya yang mempunyai dua objek yang tidak sama, yaitu objek material dan objek formal.
Objek material psikologi belajar adalah sasaran yang dipandang sebagai keseluruhan kajian psikologi belajar dalam hal ini adalah manusia yang sedang belajar. Sedangkan objek formalnya adalah bagian-bagian yang menjadi karakteristik psikologi belajar yaitu si pelajar, materi pelajaran, dan proses pembelajaran (Varia Winansih dan Tarmizi, 2010: 4-5).
Ada beberapa aspek yang menentukan keberhasilan guru dalam proses belajar mengajar, menurut Lukmanul Hakim “Tiga aspek yang mempengaruhi keberhasilan guru dalam proses belajar mengajar yaitu: kepribadian, pandangan terhadap anak didik dan latar belakang guru” (Lukmanul Hakim, 2010: 91).
3. Faktor yang Mempengaruhi Belajar
a. Faktor Internal
Faktor internal adalah faktor-faktor yang berasal dari dalam diri individu dan dapat mempengaruhi hasil belajar individu. Faktor-faktor internal ini meliputi factor fisiologis dan faktor psikologis.
Faktor-faktor fisiologis adalah faktor-faktor yang berhubungan dengan kondisi fisik individu. Faktor-faktor ini dibedakan menjadi dua macam.
- Keadaan jasmani. Keadaan jasmani pada umumnya sangat mempengaruhi aktivitas belajar seseorang. Kondisi fisik yang sehat dan bugar akan memberikan pengaruh positif terhadap kegiatan belajar individu. Sebaliknya, kondisi fisik yang lemah atau sakit akan menghambat tercapainya hasil belajar yang maksimal.
- Keadaan fungsi jasmani/fisiologis. Selama proses belajar berlangsung, peran fungsi fisiologis pada tubuh manusia sangat mempengaruhi hasil belajar, terutama panca indera. Panca indera yang berfungsi dengan baik akan mempermudah aktivitas belajar dengan baik pula.
Faktor-faktor psikologis adalah keadaan psikologis seseorang yang dapat mempengaruhi proses belajar. Beberapa faktor psikologis yang utama mempengaruhi proses belajar adalah kecerdasan siswa, motivasi, minat, sikap, bakat, konsentersi, percaya diri, kebiasaan dan cita-cita.
- Kecerdasan/intelegensi siswa
Tingkat kecerdasan siswa sangat menentukan tingkat keberhasilan belajar siswa. Ini berarti, semakin tinggi kemampuan intelijensi siswa maka semakin besar peluangnya untuk meraih sukses, sebaliknya, semakin rendah kemampuan intelijensi siswa maka semakin kecil peluangnya untuk memperoleh kesuksesan.
Setiap calon guru dan guru profesional sepantasnya menyadari bahwa keluarbiasaan intelijensi siswa, baik yang positif seperti superior maupun yang negatif seperti borderline, lajimnya menimbulkan kesuksesan belajar siswa yang bersangkutan. Disatu sisi siswa yang sangat cerdas akan merasa tidak mendapat perhatian yang memadai dari sekolah karena pelajaran yang disajikan terlampau mudah baginya. Akibatny dia enjadi bosan dan frustasi karena tuntutan kebutuhan keinginanya merasa dibendung secara tidak adil. Disisi lain, siswa yang bodoh akan merasa payah mengikuti sajian pelajaran karena terlalu sukar baginya. Karenanya siswa itu sangat tertekan, dan akhirnya merasa bosan dan frustasi seperti yang dialami rekannya yang luar biasa positif (Lukmanul Hakim, 2010: 147-148).
Para ahli membagi tingkatan IQ bermacam-macam, salah satunya adalah penggolongan tingkat IQ berdasarkan tes Stanford-Biner yang telah direvisi oleh Terman dan Merill sebagai berikut:
– Kelompok kecerdasan amat superior yaitu antara IQ 140–169
- Kelompok kecerdasan superior yaitu antara IQ 120–139
- Kelompok rata-rata tinggi (high average) yaitu antara IQ 110–119
- Kelompok rata-rata (average) yaitu antara IQ 90–109
- Kelompok rata-rata rendah (low average) yaitu antara IQ 80–89
- Kelompok batas lemah mental (borderline defective) berada pada IQ 70–79
– Kelompok kecerdasan lemah mental (mentally defective) berada pada IQ 20–69, yang termasuk dalam kecerdasan tingkat ini antara lain debil, imbisil, dan idiot.
2. Motivasi
Motivasi adalah kondisi fisiologis dan psikologis yang terdapat dala diri seseorang yang mendorong untuk melakukan aktivitas tertentu guna mencapai suat tujuan (kebutuhan) (Djali, 2008:101).
Sedangkan motivasi dalam belajar menurut Clayton Aldelfer adalah kecenderungan siswa dalam melakukan kegiatan belajar yang didorong oleh hasrat untuk mencapai prestasi hasil belajar sebaik mungkin (Nashar, 2004: 42).
Dari sudut sumbernya motivasi dibagi menjadi dua, yaitu motivasi intrinsik dan motivasi ekstrinsik. Motivasi intrinsik adalah semua faktor yang berasal dari dalam diri individu dan memberikan dorongan untuk melakukan sesuatu. Seperti seorang siswa yang gemar membaca, maka ia tidak perlu disuruh-suruh untuk membaca karena membaca tidak hanya menjadi aktivitas kesenangannyatetapi sudah mejadi kebutuhannya. Dalam proses belajar, motivasi intrinsik memiliki pengaruh yang efektif, karena motivasi intrinsik relatif lebih lama dan tidak tergantung pada motivasi dari luar (ekstrinsik).
Menurut Arden N. Frandsen, yang termasuk dalam motivasi intrinsik untuk belajar anatara lain adalah:
– Dorongan ingin tahu dan ingin menyelisiki dunia yang lebih luas
– Adanya sifat positif dan kreatif yang ada pada manusia dan keinginan untuk maju
– Adanya keinginan untuk mencapai prestasi sehingga mendapat dukungan dari orang-orang penting, misalkan orang tua, saudara, guru, dan teman-teman.
– Adanya kebutuhan untuk menguasai ilmu atau pengetahuan yang berguna baginya.
Motivasi ekstrinsik adalah faktor yang datang dari luar diri individu tetapi memberikan pengaruh terhadap kemauan untuk belajar. Seperti pujian, peraturan, tata tertib, teladan guru, orangtua, danlain sebagainya. Kurangnya respons dari lingkungansecara positif akan mempengaruhi semangat belajar seseorang menjadi lemah.
3. Ingatan
Secara teoritis, ada 3 aspek yang berkaitan dengan berfungsinya ingatan yaitu menerima kesan, menyimpan kesan, dan memproduksi kesan. Mungkin karena fungsi-fungsi inilah, istilah “ingatan” selalu didefinisikan sebagai kecakapan untuk menerima, menyimpan dan mereproduksi kesan. Kecakapan merima kesan sangat sentral peranannya dalam belajar. Melalui kecakapan inilah, subjek didik mampu mengingat hal-hal yang dipelajarinya. Dalam konteks pembelajaran, kecakapan ini dapat dipengaruhi oleh beberapa hal, di antaranya teknik pembelajaran yang digunakan pendidik. Teknik pembelajaran yang disertai dengan alat peraga kesannya akan lebih dalam pada siwa.
Di samping itu, pengembangan teknik pembelajaran yang mendayagunakan “titian ingatan” juga lebih mengesankan bagi siswa, terutama untuk material pembelajaran berupa rumus-rumus atau urutan-urutan lambang tertentu.
4. Minat
Minat adalah kecenderungan yang tetap untuk memperhatikan dan mengenang beberapa kegiatan. Kegiatan yang diminati seseorang, diperhatikan terus menerus yang disertai rasa senang. Jadi berbeda dengan perhatian, karena perhatian sifatnya sementara dan belum tentu diikuti dengan rasa senang, sedangkan minat selalu diikuti dengan rasa senang dan dari situlah diperoleh kepuasan (Slameto, 2003: 57)
Secara sederhana, minat (interest) berarti kecenderungan dan kegairahan yang tinggi atau keinginan yang besar terhadap sesuatu. Namun lepas dari kepopulerannya, minat sama halnya dengan kecerdasan dan motivasi, karena memberi pengaruh terhadap aktivitas belajar, ia akan tidak bersemangat atau bahkan tidak mau belajar. Oleh karena itu, dalam konteks belajar di kelas, seorang guru atau pendidik lainnya perlu membangkitkan minat siswa agar tertarik terhadap materi pelajaran yang akan dihadapainya atau dipelajaranya.
Untuk membangkitkan minat belajar tersebut, banyak cara yang bisa digunakan antara lain:
- Dengan membuat materi yang akan dipelajari semenarik mungkin dan tidak membosankan, baik dari bentuk buku materi, desain pembelajaran yang membebaskan siswa mengeksplore apa yang dipelajari, melibatkan seluruh domain belajar siswa (kognitif, afektif, psikomotorik) sehingga siswa menjadi aktif, maupun performansi guru yang menarik saat mengajar.
- Pemilihan jurusan atau bidang studi. Dalam hal ini, alangkah baiknya jika jurusan atau bidang studi dipilih sendiri oleh siswa sesuai dengan minatnya.
5. Sikap
Dalam proses belajar, sikap individu dapat mempengaruhi keberhasilan proses belajarnya. Sikap adalah gejala internal yang mendimensi afektif berupa kecenderungan untuk mereaksi atau merespons dangan cara yang relatif tetap terhadap obyek, orang, peristiwa dan sebagainya, baik secara positif maupun negatif.
Sikap juga merupakan kemampuan memberikan penilaian tentang sesuatu yang membawa diri sesuia dengan penilaian. Adanya penilaian tentang sesuatu mengakibatkan terjadinya sikap menerima, menolak, atau mengabaikan. Siswa memperoleh kesempatan belajar. Meskipun demikian, siswa dapat menerima, menolak, atau mengabaikan kesempatan belajar tersebut.
6. Bakat
Faktor psikologis lain yang mempengaruhi proses belajar adalah bakat. Bakat atau aptitude merupakan kecakapan potensial yang bersifat khusus, yaitu khusus dalam suatu bidang atau kemampuan tertentu (Nana Syaodih Sukamdinata, 2011: 101)
Apabila bakat seseorang sesuai dengan bidang yang sedang dipelajarinya, maka bakat itu akan mendukung proses belajarnya sehingga kemungkinan besar ia akan berhasil. Pada dasarnya setiap orang mempunyai bakat atau potensi untuk mencapai prestasi belajar sesuai dengan kemampuannya masing-masing.
Karena itu, bakat juga diartikan sebagai kemampuan dasar individu untuk melakukan tugas tertentu tanpa tergantung upaya pendidikan dan latihan. Individu yang telah mempunyai bakat tertentu, akan lebih mudah menyerap informasi yang berhubungan dengan bakat yang mempelajari bahasa-bahasa yang lain selain bahasanya sendiri. Karena belajar juga dipengaruhi oleh potensi yang dimilki setiap individu, maka para pendidik, orangtua, dan guru perlu memperhatikan dan memahami bakat yang dimilki oleh anaknya atau peserta didiknya, anatara lain dengan mendukung, ikut mengembangkan, dan tidak memaksa anak untuk memilih jurusan yang tidak sesuai dengan bakatnya.
7. Konsentrasi Belajar
Konsentrasi belajar merupakan kemampuan memusatkan perhatian pada pelajaran. Pemusatan perhatian tersebut tertuju pada isi bahan belajar maupun proses memperolehnya. Untuk memperkuat perhatian pada pelajaran, guru perlu menggunakan bermacam-macam strategi belajar-mengajar, dan memperhitungkan waktu belajar serta selingan istirahat. Dalam pengajaran klasikal, menurut Rooijakker, kekuatan perhatian selama tiga puluh menit telah menurun. Ia menyarankan agar guru memberikan istirahat selingan beberapa menit.
8. Rasa Percaya Diri
Rasa percaya diri timbul dari keinginan mewujudkan diri bertindak dan berhasil. Dari segi perkembangan, rasa percaya diri dapat timbul berkat adanya pengakuan dari lingkungan. Dalam proses belajar diketahui bahwa unjuk prestasi merupakan tahap pembuktian “perwujudan diri” yang diakui oleh guru dan teman- temannya. Semakin sering berhasil menyelesaikan tugas, maka semakin besar pula memperoleh pengakuan dari umum dan selanjutnya rasa percaya diri semakin kuat.
Hal yang sebaliknya pun dapat terjadi. Kegagalan yang berulang kali dapat menimbulkan rasa tidak percaya diri. Bila rasa tidak percaya diri sangat kuat, maka diduga siswa akan menjadi takut belajar. Rasa takut belajar tersebut terjalin secara komplementer dengan rasa takut gagal lagi. Maka, guru sebaiknya mendorong keberanian siswa secara terus-menerus, memberikan bermacam-macam penguat dan memberikan pengakuan dan kepercayaan bagi siswa.
9. Kebiasaan Belajar
Dalam kegiatan sehari-hari ditemukan adanya kebiasaan belajar yang kurang baik. Kebiasaan belajar tersebut antara lain:
- Belajar pada akhir semester
- Belajar tidak teratur
- Menyia-nyiakan kesempatan belajar
- Bersekolah hanya untuk bergengsi
- Dating terlambat bergaya seperti pemimpin
- Bergaya jantan seperti merokok, sok menggurui teman lain,
- Bergaya minta “belas kasihan” tanpa belajar.
Kebiasaa-kebiasaan buruk tersebut dapat ditemukan di sekolah yang ada di kota besar, kota kecil, pedesaan dan sekolah-sekolah lain. Untuk sebagian orang, kebiasaan belajar tersebut disebabkan oleh ketidak mengertian siswa pada arti belajar bagi diri sendiri. Hal seperti ini dapat diperbaiki dengan pembinaan disiplin membelajarkan diri.
10. Cita-cita Siswa
Pada umumnya, setiap anak memiliki suatu cita-cita dalam hidup. Cita-cita itu merupakan motivasi instrinsik. Tetapi, ada kalanya “gambaran yang jelas” tentang tokoh teladan bagi siswa belum ada. Akibatnya, siswa hanya berprilaku ikut-ikutan.
Cita-cita sebagai motivasi instrinsik perlu dididikan. Penanaman memiliki cita-cita harus dimulai sejak sekolah dasar. Di sekolah menengah didikan pemilikan dan pencapaian cita–cita sudah semakin terarah. Cita-cita merupakan wujud eksplorasi dan emansipasi diri siswa. Penanaman pemilikan dan pencapaian cita-cita sudah sebaiknya berpangkal dari kemampuan berprestasi, dimulai dari hal yang sederhana ke yang semakin sulit. Dengan mengaitkan pemilikan cita-cita dengan kemampuan berprestasi, maka siswa diharapkan berani bereksplorasi sesuai dengan kemampuan dirinya sendiri.
2. Faktor Eksternal
Selain karakteristik siswa atau faktor-faktor endogen, faktor-faktor eksternal juga dapat memengaruhi proses belajar siswa.dalam hal ini, faktor-faktor eksternal yang memengaruhi balajar dapat digolongkan menjadi dua golongan, yaitu faktor lingkungan social dan faktor lingkungan nonsosial.
Yang termasuk lingkungan sosial adalah pergaulan siswa dengan orang lain disekitarnya, sikap dan perilaku orang disekitar siswa dan sebagainya. Lingkungan sosial yang banyak mempengaruhi kegiatan belajar ialah orangtua dan keluarga siswa itu sendiri. Sifat-sifat orangtua, peraktk pengelolaan keluarga, ketegangan keluarga, semuanya dapat memberi dampak baik ataupun buruk terhadap kegitan belajar dan hasil yang dicapai oleh siswa.
- Lingkungan sosial sekolah
Seperti guru, administrasi, dan teman-teman sekelas dapat memengaruhi proses belajar seorang siswa. Hubungan harmonis antra ketiganya dapat menjadi motivasi bagi siswa untuk belajar lebih baikdisekolah. Perilaku yang simpatik dan dapat menjadi teladan seorang guru atau administrasi dapat menjadi pendorong bagi siswa untuk belajar.
2. Lingkungan sosial masyarakat.
Kondisi lingkungan masyarakat tempat tinggal siswa akan memengaruhi belajar siswa. Lingkungan siswa yang kumuh, banyak pengangguran dan anak terlantar juga dapat memengaruhi aktivitas belajarsiswa, paling tidak siswa kesulitan ketika memerlukan teman belajar, diskusi, atau meminjam alat-alat belajar yang kebetulan belum dimilkinya.
3. Lingkungan sosial keluarga.
Lingkungan ini sangat memengaruhi kegiatan belajar. Ketegangan keluarga, sifat-sifat orangtua, demografi keluarga (letak rumah), pengelolaan keluarga, semuannya dapat memberi dampak terhadap aktivitas belajar siswa. Hubungan anatara anggota keluarga, orangtua, anak, kakak, atau adik yang harmonis akan membantu siswa melakukan aktivitas belajar dengan baik.
Faktor-faktor yang termasuk lingkungan nonsosial adalah:
- Lingkungan alamiah
Adalah lingkungan tempat tinggal anak didik, hidup, dan berusaha didalamnya. Dalam hal ini keadaan suhu dan kelembaban udara sangat berpengaruh dalam belajar anak didik. Anak didik akan belajar lebih baik dalam keadaan udara yang segar. Dari kenyataan tersebut, orang cenderung akan lebih nyaman belajar ketika pagi hari, selain karena daya serap ketika itu tinggi. Begitu pula di lingkungan kelas. Suhu dan udara harus diperhatikan. Agar hasil belajar memuaskan. Karena belajar dalam keadaan suhu panas, tidak akan maksimal (Syaiful Bahri Djamarah, 2002: 143-144).
2. Faktor instrumental
Yaitu perangkat belajar yang dapat digolongkan dua macam. Pertama, hardware, seperti gedung sekolah, alat-alat belajar, fasilitas belajar, lapangan olah raga dan lain sebagainya. Kedua, software, seperti kurikulum sekolah, peraturan-peraturan sekolah, buku panduan, silabi dan lain sebagainya.
3. Faktor materi pelajaran (yang diajarkan ke siswa).
Faktor ini hendaknya disesuaikan dengan usia perkembangan siswa begitu juga dengan metode mengajar guru, disesuaikan dengan kondisi perkembangan siswa. Karena itu, agar guru dapat memberikan kontribusi yang postif terhadap aktivitas belajr siswa, maka guru harus menguasai materi pelajaran dan berbagai metode mengajar yang dapat diterapkan sesuai dengan konsdisi siswa
BAB III
PENUTUP
A. Kesimpulan
Berdasarkan penjelasan diatas dapat diambil kesimpulan yaitu, belajar adalah suatu usaha atau kegiatan yang bertujuan untuk mengadakan perubahan di dalam diri seseorang, mencakup perubahan tingkah laku, sikap, kebiasaan, ilmu pengetahuan, keterampilan dan sebagainya.
Sains atau Ilmu Pengetahuan Alam adalah ilmu yang pokok bahasannya adalah alam dengan segala isinya. Hal yang dipelajari dalam sains adalah sebab-akibat, hubungan kausal dari kejadian-kejadian yang terjadi di alam. Pembelajaran sains menekankan pada pemberian pengalaman langsung. Dengan demikian, siswa perlu dibantu untuk mampu mengembangkan sejumlah pengetahuan yang menyangkut kerja ilmiah dan pemahaman konsep serta aplikasinya
Faktor- faktor yang mempengaruhi proses belajar terdiri atas faktor internal dan eksternal. Faktor internal adalah faktor-faktor yang berasal dari dalam diri individu dan dapat mempengaruhi hasil belajar individu. Faktor-faktor internal ini meliputi faktor fisiologis dan faktor psikologis. Sedangkan faktor eksternal yang memengaruhi balajar dapat digolongkan menjadi dua golongan, yaitu faktor lingkungan sosial dan factor lingkungan nonsosial.
DAFTAR PUSTAKA
Djali. 2008. Psikologi Pendidikan. Jakarta: Bumi Aksara.
Djamarah, Bahri Syaiful. 2002. Psikologi Belajar. Jakarta: CV Rineka Cipta.
Hakim, Lukmanul. 2010. Perencanaan Pembelajaran. Bandung: CV Wacana Prima.
Mardianto. 2009. Psikologi Pendidikan. Bandung: Citapustaka Media Perintis
Nashar. 2004. Peranan Motivasi dan Kemampuan Awal Dalam Kegiatan Pembelajaran. Jakarta: Delia Press.
Purwanto, Ngalim.1990. Psikologi Pendidikan. Bandung: Rosda Karya.
Slameto.2003. Belajar dan faktor- faktor yang mempengaruhinya. Jakarta: Rineka Cipta.
Sukmadinato, Syaodih, Nana.2011. Landasan Psikologi Proses Pendidikan. Bandung: Remaja Rosdakarya.
Syah, Muhibbin, 2010. Psikologi Pendidikan dengan Pendekatan Baru. Bandung: PT. Remaja Rosdakarya.
Syah, Muhibbin. 2003. Psikologi Belajar. Jakarta : Raja Grafindo Persada.
Winarsih, Varia dan Tarmizi. 2010. Diktat Psikologi Belajar. Medan: USU.


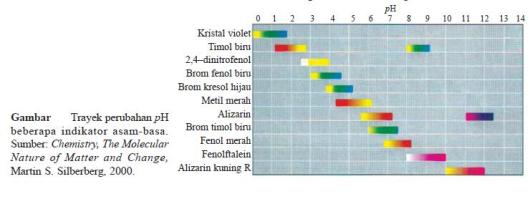
 Senyawa sam – basa dapat diidentifikasi menggunakan kertas lakmus dengan cara mengamati perubahan warna kertas lakmus ketika bereaksi dengan larutan. Ada dua macam kertas lakmus yaitu kertas lakmus merah dan kertas lakmus biru.
Senyawa sam – basa dapat diidentifikasi menggunakan kertas lakmus dengan cara mengamati perubahan warna kertas lakmus ketika bereaksi dengan larutan. Ada dua macam kertas lakmus yaitu kertas lakmus merah dan kertas lakmus biru.

















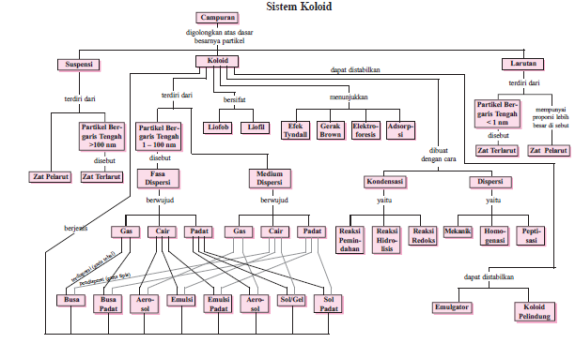
 Istilah koloid pertama kali diutarakan oleh seorang ilmuwan Inggris, Thomas Graham, sewaktu mempelajari sifat difusi beberapa larutan melalui membrane kertas perkamen. Graham menemukan bahwa larutan natrium klorida mudah berdifusi sedangkan kanji, geatin dan putih telur sangat lambat atau sama sekali tidak berdifusi. Zat-zat yang sukar berdifusi disebut koloid (Handayana, 2002).
Istilah koloid pertama kali diutarakan oleh seorang ilmuwan Inggris, Thomas Graham, sewaktu mempelajari sifat difusi beberapa larutan melalui membrane kertas perkamen. Graham menemukan bahwa larutan natrium klorida mudah berdifusi sedangkan kanji, geatin dan putih telur sangat lambat atau sama sekali tidak berdifusi. Zat-zat yang sukar berdifusi disebut koloid (Handayana, 2002).

 Partikel debu, banyak diantaranya terlalu kecil untuk dilihat, akan nampak sebagai titik-titik terang dalam suatu berkas cahaya. Bila partikel itu memang berukuran koloid, partikel itu sendiri tidak nampak; yang terlihat ialah cahaya yang dihamburkan oleh mereka. Hamburan cahaya itu disebut efek tyndall. Ini disebabkan oleh fakta bahwa partikel kecil menghamburkan cahaya dalam segala arah.
Partikel debu, banyak diantaranya terlalu kecil untuk dilihat, akan nampak sebagai titik-titik terang dalam suatu berkas cahaya. Bila partikel itu memang berukuran koloid, partikel itu sendiri tidak nampak; yang terlihat ialah cahaya yang dihamburkan oleh mereka. Hamburan cahaya itu disebut efek tyndall. Ini disebabkan oleh fakta bahwa partikel kecil menghamburkan cahaya dalam segala arah. Jika suatu mikroskop optis difokuska pada suatu dispersi koloid pada arah yang tegak lurus pada berkas cahaya dan dengan latar belakang gelap, akan nampak partikel-partikel koloid, bukan sebagai partikel dengan batas yang jelas, melainkan sebagai bintik yang berkilauan. Dengan mengikuti bintik-bintik cahaya yang dipantulkan ini, orang dapat melihat bahwa partikel koloid yang terdispersi ini bergerak terus-menerus secara acak menurut jalan yang berliku-liku. Gerakan acak partikel koloid dalam suatu medium pendispersi ini disebut gerakan brown, menurut nama seorang ahli botani Inggris, Robert Brown, yang mempelajarinya dalam tahun 1827.
Jika suatu mikroskop optis difokuska pada suatu dispersi koloid pada arah yang tegak lurus pada berkas cahaya dan dengan latar belakang gelap, akan nampak partikel-partikel koloid, bukan sebagai partikel dengan batas yang jelas, melainkan sebagai bintik yang berkilauan. Dengan mengikuti bintik-bintik cahaya yang dipantulkan ini, orang dapat melihat bahwa partikel koloid yang terdispersi ini bergerak terus-menerus secara acak menurut jalan yang berliku-liku. Gerakan acak partikel koloid dalam suatu medium pendispersi ini disebut gerakan brown, menurut nama seorang ahli botani Inggris, Robert Brown, yang mempelajarinya dalam tahun 1827.
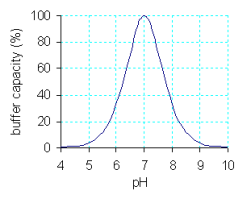



 Buffer karbonat yaitu pasangan asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3–):
Buffer karbonat yaitu pasangan asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3–): Oksigen merupakan zat utama yang diperlukan oleh sel tubuh yang didapatkan melalui pernapasan. Oksigen diikat oleh hemoglobin di dalam darah, di mana O2 sangat sensitif terhadap pH. Reaksi kesetimbangan yang terjadi dapat dituliskan sebagai berikut.
Oksigen merupakan zat utama yang diperlukan oleh sel tubuh yang didapatkan melalui pernapasan. Oksigen diikat oleh hemoglobin di dalam darah, di mana O2 sangat sensitif terhadap pH. Reaksi kesetimbangan yang terjadi dapat dituliskan sebagai berikut. Adapun kandungan dari OTM atau obat tetes mata adalah Cendoxytrol, digunakan pada mata merah yang berkaitan dengan alergi. Karakteristik yang penting pada obat tetes mata yaitu buffer (larutan penyangga) atau pH. Idealnya sediaan optalmik harus diformulasikan pada pH yang ekuivalen dengan pH cairan air mata yaitu 7,4. Pada kenyataannya, hal ini jarang digunakan. Mayoritas bahan aktif digunakan dalam pengobatan mat adalah garam-garam dari basa lemah dan hampir stabil pada pH asam.Beberapa suspensi biasanya lebih stabil pada pH asam. pH adjustmen umumnya memerlukan persetujuan formulator. pH yang dipilih harus optimum untuk stabilitas. Sistem buffer dipilih harus membunya kapasitas memadai untuk menjaga pH dalam rentang stabilitas selama durasi produk. Namun ada sebagian obat tetes mata yang mengandung steroid. Steroid adalah salah satu kandungan berbahaya yang apabila digunakan pada mata. Meski tetes mata yang memiliki steroid lebih cepat sembuh, tapi steroid sendiri memiliki efek samping yaitu katarak dan glukoma. Penyakit glukoma merupakan salah satu penyakit mata yang dapat menyebabkan kebutaan. Hal ini disebabkan karena saluran cairan yang keluar dari bola mata terhambat, sehingga bola mata akan membesar dan menekan saraf mata yang berada di belakang bola mata. Alhasil, saraf mata tidak mendapatkan aliran darah sehingga saraf mata akan mati. Selain itu, obat tetes mata yang mengandung kortikosteroid ini dapat juga menyebabkan kulit kelopak mata menjadi atropi, tukak lambung, insomnia, ptosis, kerusakan kornea, retardasi mental, jerawat, hipertensi, dan pikosis.
Adapun kandungan dari OTM atau obat tetes mata adalah Cendoxytrol, digunakan pada mata merah yang berkaitan dengan alergi. Karakteristik yang penting pada obat tetes mata yaitu buffer (larutan penyangga) atau pH. Idealnya sediaan optalmik harus diformulasikan pada pH yang ekuivalen dengan pH cairan air mata yaitu 7,4. Pada kenyataannya, hal ini jarang digunakan. Mayoritas bahan aktif digunakan dalam pengobatan mat adalah garam-garam dari basa lemah dan hampir stabil pada pH asam.Beberapa suspensi biasanya lebih stabil pada pH asam. pH adjustmen umumnya memerlukan persetujuan formulator. pH yang dipilih harus optimum untuk stabilitas. Sistem buffer dipilih harus membunya kapasitas memadai untuk menjaga pH dalam rentang stabilitas selama durasi produk. Namun ada sebagian obat tetes mata yang mengandung steroid. Steroid adalah salah satu kandungan berbahaya yang apabila digunakan pada mata. Meski tetes mata yang memiliki steroid lebih cepat sembuh, tapi steroid sendiri memiliki efek samping yaitu katarak dan glukoma. Penyakit glukoma merupakan salah satu penyakit mata yang dapat menyebabkan kebutaan. Hal ini disebabkan karena saluran cairan yang keluar dari bola mata terhambat, sehingga bola mata akan membesar dan menekan saraf mata yang berada di belakang bola mata. Alhasil, saraf mata tidak mendapatkan aliran darah sehingga saraf mata akan mati. Selain itu, obat tetes mata yang mengandung kortikosteroid ini dapat juga menyebabkan kulit kelopak mata menjadi atropi, tukak lambung, insomnia, ptosis, kerusakan kornea, retardasi mental, jerawat, hipertensi, dan pikosis.
 Sitrat sangat baik digunakan dalam larutan penyangga untuk mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air. Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna putih. Serbuk Kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul asam sitrat. Bentuk anhydrous asam sitrat mengkristal dalam air panas, sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam air dingin. Bentuk monohidrat tersebut dapat diubah menjadi bentuk anhydrous dengan pemanasan di atas 74 °C.
Sitrat sangat baik digunakan dalam larutan penyangga untuk mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air. Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna putih. Serbuk Kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul asam sitrat. Bentuk anhydrous asam sitrat mengkristal dalam air panas, sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam air dingin. Bentuk monohidrat tersebut dapat diubah menjadi bentuk anhydrous dengan pemanasan di atas 74 °C. Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan pH pada perut. Perubahan pH ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.
Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan pH pada perut. Perubahan pH ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.